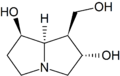Alcaloïde pyrrolizidinique
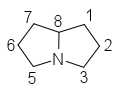
Les alcaloïdes pyrrolizidiniques forment une classe d'alcaloïdes et de métabolites secondaires, caractérisés par une structure pyrrolizidine formée de deux cycles pyrroles. Ces alcaloïdes sont produits par les plantes et constituent un mécanisme de défense contre les animaux herbivores.
Il n'a été trouvé aucune application thérapeutique à ces alcaloïdes et c'est plutôt leur toxicité qui doit retenir l'attention[1].

Répartition[modifier | modifier le code]
Plus de 200 alcaloïdes pyrrolizidiniques ont été identifiés dans treize familles de plantes[2]. Une analyse italienne portant sur 117 herbes et 7 mélanges commerciaux par spectrométrie de masse à haute résolution (2017) montre la présence d'alcaloïdes dans 52 % des plantes et 42 % des mélanges commerciaux, 26 % des échantillons contenant des alcaloïdes pyrrolozidiniques. Leur migration dans des infusions faites à la maison a été confirmée[3].
On les rencontre principalement chez toutes les plantes de la famille des Boraginaceae, chez les Asteraceae et plus accessoirement les Fabaceae, dans les genres Crotalaria, Chromolaena et Lotononis, chez les Apocynaceae, les Euphorbiaceae, les Orchidaceae, les Poaceae, etc.
| Famille | Nom commun | Nom scientifique | alcaloïdes pyrrolizidiniques |
|---|---|---|---|
| Boraginaceae | Bourrache | Borago officinalis L. | lycopsamine, amabiline, supinine |
| Consoude | Symphytum officinale L. | lycopsamine, intermédine, symphytine | |
| Asteraceae | Tussilage | Tussilago farfara L. | senkirkine, sénécionine |
| Eupatoire | Eupatorium cannabinum L. | échinatine, lycopsamine, intermédine, rindérine | |
| Séneçon de Jacob | Senecio jacobaea L. | esters de la rétronécine : jacobine, éruciflorine, sénéciphylline, sénécionine | |
| Séneçon commun | Senecio vulgaris L. | sénéciphylline, sénécionine, rétrorsine, spatioidine, usaramine, intégerrimine |
Structure[modifier | modifier le code]
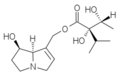
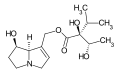
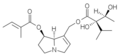
La plupart des alcaloïdes pyrrolizidiniques sont des esters formés entre des aminoalcools et un ou deux acides carboxyliques aliphatiques[1].
Les aminoalcools concernés dérivent de la pyrrolizidine et sont appelés des nécines. La dénomination d'un certain nombre d'entre eux se fait à partir du radical nécine : rétro.nécine, platy.nécine, rosmari.nécine etc. Le cycle est toujours substitué par un groupe hydroxyméthyle (–CH2OH) en C-1 et avec parfois une fonction alcool secondaire (–OH) en C-7 (rétronécine, héliotridine, platynécine) ou en C-2 (rosmarinécine) ou en C-6 (crotanécine). La liaison 1-2 peut être double.
-
pyrrolizidine
-
rétronécine
-
rosmarinécine
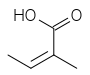
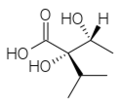
Les acides qui estérifient les nécines sont appelés acides néciques. Ce sont des acides aliphatiques en C5 (acide angélique, acide tiglique), C7 (acide lasiocarpique, (+)-trachélanthique, (-)-viridiflorique, etc.), C8 (acide monocrotalique) ou C10 (acide sénécique, jacobinécique, rétronécique)
-
acide angélique
-
acide tiglique
-
acide (+)-trachélanthique
Les composés sont des mono- et diesters :
-
intermédine
-
lycopsamine
-
symphytine (7-tiglyl-9-viridiflorylrétronécine)
ou des diesters macrocycliques (les pyrrolizidines 7,9-diols sont estérifiés par un acide dicarboxylique)
-
R=H : sénécionine
R=OH : rétrorsine -
senkirkine
La voie de synthèse de ces alcaloïdes part de la L-ornithine chez les plantes et la L-arginine, chez les animaux.
Toxicité[modifier | modifier le code]
La plupart des alcaloïdes pyrrolizidiniques[4],[5] sont mutagènes et inducteurs de tumeurs hépatiques.
Il a été montré chez le rat[1] que des alcaloïdes pyrrolizidiniques comme les rétrorsine, senkirkine, monocrotaline, lasiocarpine et symphytine et plusieurs plantes (Tussilago farfara L., Symphytum officinale L., Petasites japonicus Maxim. etc.) pouvaient provoquer des tumeurs hépatiques lorsqu'ils sont administrés régulièrement par voie orale. Il a aussi été prouvé expérimentalement que plusieurs alcaloïdes du groupe étaient mutagènes et tératogènes.
Les diesters macrocycliques (sénécionine, rétrorsine, sénéciphylline, ridelline) sont les plus toxiques. Puis viennent les diesters, qui sont plus toxiques que les monoesters.
Chez l'homme[modifier | modifier le code]
La consommation régulière d'herbes médicinales[6] contenant ces composés peut être responsable de graves intoxications hépatiques. L'intoxication chronique se traduit par une perte d'appétit, des douleurs, une distension abdominale, une augmentation du volume du foie (hépatomégalie).
Toutes les parties de la consoude (Symphytum officinale) contiennent des alcaloïdes pyrrolizidiniques comme l'intermédine, la lycopsamine, la 7-acétyl-intermédine. En raison de leur toxicité, l'usage interne de Symphytum officinale est interdit dans de nombreux pays.
En Guadeloupe, une plante commune, la sonnette (Crotalaria retusa L.) sert à confectionner un "thé de sonnette" remède populaire contre beaucoup d'indispositions. D'après Fournet[7] "De nombreux cas d'intoxications graves ont été constatés, surtout chez les enfants".
Les autres "plantes médicinales" contenant ces composés hépatotoxiques sont : le tussilage, la bourrache, héliotropes, cynoglosses et séneçons etc.
Des alcaloïdes pyrrolizidiniques ont été identifiés dans les herbes médicinales de Chine[8], d'Amérique du Sud et du Sri Lanka[2].
Chez les animaux[modifier | modifier le code]
En général, le bétail évite les plantes à alcaloïdes pyrrolizidiniques. Mais des fourrages et des ensilages contaminés peuvent conduire à une intoxication chronique. Les animaux les plus sensibles sont les porcs, suivis par les chevaux et les bovins et les chèvres. Le lait de vache ou de chèvre peut être contaminé par ces composés hépatotoxiques.
De grands épisodes d'empoisonnement ont été décrits en Afghanistan, en Inde et dans l'ancienne URSS du fait de la contamination des récoltes de blé par des Boraginacées[2] (Heliotropium lasiocarpum, H. popovii, H. europaeum).
Certains insectes se nourrissent de plantes qui contiennent des alcaloïdes pyrrolizidiniques. C'est le cas de lépidoptères de la sous-famille des Danainae, qui font différents usages de ces molécules. Par exemple, la danaidone est une phéromone sexuelle dérivée d'alcaloïdes pyrrolizidiniques qui est émise par les mâles pour attirer les femelles[9],[10].
Plantes contenant des alcaloïdes pyrrolizidiniques[modifier | modifier le code]
Ces alcaloïdes ont été trouvés dans 350 espèces de plantes. En voici un échantillon :
- Ageratum conyzoides
- Ageratum houstonianum [11]
- Arnebia euchroma
- Borago officinalis, bourrache
- Cacalia hastata
- Cacalia hupehensis
- Chromolaena odorata
- Cordia myxa
- Crassocephalum crepidioides
- Crotalaria albida
- Crotalaria assamica
- Crotalaria mucronata
- Crotalaria sesseliflora
- Crotalaria tetragona
- Cuminum cyminum, cumin
- Cynoglossum amabile
- Cynoglossum lanceolatum
- Cynoglossum officinale
- Cynoglossum zeylanicum
- Echium plantagineum[12]
- Emilia sonchifolia
- Eupatorium cannabinum
- Eupatorium chinense
- Eupatorium fortunei
- Eupatorium japonicum
- Farfugium japonicum
- Gynura bicolor
- Gynura divaricata
- Gynura segetum
- Heliotropium amplexicaule[12]
- Heliotropium europaeum[12]
- Heliotropium indicum
- Lappula intermedia
- Ligularia cymbulifera
- Ligularia dentata
- Ligularia duiformis
- Ligularia heterophylla
- Ligularia hodgsonii
- Ligularia intermedia
- Ligularia lapathifolia
- Ligularia lidjiangensis
- Ligularia platyglossa
- Ligularia tongolensis
- Ligularia tsanchanensis
- Ligularia vellerea
- Liparis nervosa
- Lithospermum erythrorizon
- Origanum majorana, marjolaine
- Origanum vulgare, origan
- Petasites japonicus
- Senecio argunensis
- Senecio brasiliensis[13]
- Senecio chrysanthemoides
- Senecio integrifolius var. fauriri
- Senecio jacobaea[12]
- Senecio lautus[12]
- Senecio linearifolius[12]
- Senecio madagascariensis[12]
- Senecio nemorensis
- Senecio quadridentatus[12]
- Senecio scandens
- Senecio vulgaris, séneçon commun
- Syneilesis aconitifolia
- Symphytum officinale [14], consoude
- Tussilago farfara, tussilage
Notes et références[modifier | modifier le code]
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- (en) Arungundrum S. Prakash, Tamara N. Pereira, Paul E.B. Reilly, Alan A. Seawright, « Pyrrolizidine alkaloids in human diet », Mutation Research, vol. 443, .
- (en) Tiziana Nardin, Edi Piasentier, Chiara Barnaba et Roberto Larcher, « Alkaloid profiling of herbal drugs using high resolution mass spectrometry », Drug Testing and Analysis, , n/a–n/a (ISSN 1942-7611, DOI 10.1002/dta.2252, lire en ligne, consulté le )-
- (en) Hideki Mori, Shigeyuki Sugie, Naoki Yoshimi, Yoshihisa Asada, Tsutomu Furuya, and Gary M. Williams, « Genotoxicity of a Variety of Pyrrolizidine Alkaloids in the Hepatocyte Primary Culture-DNA Repair Test Using Rat, Mouse, and Hamster Hepatocytes », Cancer Research, vol. 45, , p. 3125-3129
- Inchem
- (en) COULOMBE Roger A., « Pyrrolizidine alkaloids in foods », Advances in food and nutrition research, vol. 45,
- Jacques Fournet, Flore illustrée des phanérogames de Guadeloupe et de Martinique, Gondwana éditions, Cirad,
- Fu, P.P., Yang, Y.C., Xia, Q., Chou, M.C., Cui, Y.Y., Lin G., "Pyrrolizidine alkaloids-tumorigenic components in Chinese herbal medicines and dietary supplements", Journal of Food and Drug Analysis, Vol. 10, No. 4, 2002, p. 198-211[1]
- (en) Dietrich Schneider, Michael Boppré, Heidwig Schneider, William R. Thompson, Clinton J. Boriaek, Robert L. Petty et Jerrold Meinwald, « A pheromone precursor and its uptake in male Danaus butterflies », Journal of Comparative Physiology, vol. 97, , p. 245-256 (lire en ligne, consulté le ).
- (en) Keiichi Honda, Yasuyuki Honda, Satoshi Yamamoto et Hisashi Ômura, « Differential utilization of pyrrolizidine alkaloids by males of a danaid butterfly, Parantica sita, for the production of danaidone in the alar scent organ », Journal of Chemical Ecology, vol. 31, no 4, , p. 959-964 (DOI 10.1007/s10886-004-1791-x, lire en ligne, consulté le ).
- Wiedenfeld H, Andrade-Cetto A., "Pyrrolizidine alkaloids from Ageratum houstonianum Mill.", Phytochemistry, 2001 Aug, p. 1269-71[2]
- The MERCK Vetinary Manual, Table 5. [3]
- Rizk A. M. (1990), Naturally Occurring Pyrrolizidine Alkaloids. CRC Press, Boca Raton, FL, USA
- Yeong M.L., et al.(1990), “Hepatic veno-occlusive disease associated with comfrey ingestion.” Journal of Gastroenterology and Hepatology, 5(2): p. 211-4.
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) Subhuti Dharmananda, « Safety Issues Affecting Herbs:Pyrrolizidine Alkaloids », Institute for Traditional Medicine and Preventive Health Care (ITM) (consulté le ).